A água (H2O, HOH) é a molécula mais abundante na superfície da Terra, e cobre cerca de 70% de sua superfície nas formas líquida e gasosa, além de ser encontrada na atmosfera terrestre como vapor. Está em equilíbrio dinâmico entre os estados líquido e gasoso nas condições ambientes de temperatura e pressão (21-23 °C, 1 atm). À temperatura ambiente, é um líquido fracamente azul, praticamente incolor, insípido e inodoro. Muitas substâncias se dissolvem na água e ela é comumente chamada "solvente universal". Por isso, a água na natureza e em uso raramente é pura, e pode apresentar propriedades diferentes daquelas encontradas no laboratório. Entretanto, há muitos compostos que são essencialmente, se não completamente, insolúveis em água. A água é a única substância comum encontrada em todos os três estados comuns da matéria. A água compõe cerca de 75% do corpo humano.
Formas da água
A água pode assumir várias formas. O estado sólido da água é comumente conhecido como gelo (mas também existem muitas outras formas; veja sólido amorfo e gelo amorfo); o estado gasoso é conhecido como vapor d'água, e a fase líquida comum é geralmente chamada simplesmente de água. Acima de certa temperatura e pressão crítica (647 K e 22,064 MPa), as moléculas de água assumem uma condição supercrítica, em que aglomerados líquidos flutuam numa fase de vapor.

A água pesada é a água cujo hidrogênio é substituído pelo seu isótopo mais pesado, o deutério. A água pesada é quimicamente quase igual à água normal. É usada na indústria nuclear para desaceleração de nêutrons.
Nomenclatura sistemática
A nomenclatura IUPAC aceita para a água é simplesmente "água", mas há dois outros nomes que podem ser usados para descrever a molécula.
O primeiro e mais sistemático é óxido de hidrogênio. Esse nome é análogo ao de compostos correlatos, como o peróxido de hidrogênio (água oxigenada), o sulfeto de hidrogênio e o óxido dedeutério (água pesada). Um outro nome sistemático, oxidano, é aceito pela IUPAC como um nome pai para a nomenclatura sistemática de grupos substituintes baseados em oxigênio,apesar de mesmo estes comumente terem outros nomes recomendados. Por exemplo, o nome hidroxila é recomentado no lugar de oxidanila para o grupo −OH. O nome oxano é explicitamente mencionado pela IUPAC como incompatível com esse propósito, pois já é o nome de um éter cíclico também conhecido como tetra-hidropirano no sistema de Hantzsch-Widman; dentre os compostos semelhantes, existem o dioxano e o trioxano.
Nomenclatura sistemática e humor
Monóxido de diidrogênio (às vezes Monóxido de di-hidrogênio), ou DHMO é um nome sistemático um tanto pedante para a água. O termo foi usado em paródias de pesquisas químicas que clamavam pela abolição dessa "substância química letal". Na verdade, um nome sistemático mais realista seria simplesmente óxido de hidrogênio, já que os prefixos "mono-" e "di-" são supérfluos. O sulfeto de hidrogênio, H2S, nunca é chamado de "monossulfeto de diidrogênio", e o peróxido de hidrogênio, H2O2, nunca é chamado de "dióxido de diidrogênio".
Algumas fichas de dados de segurança de material a respeito da água, exagerando, dizem: "Cuidado! Pode causar afogamento!"
Um outro nome sistemático para a água é ácido hidróxico, ou ácido hidroxílico. De maneira semelhante, o nome para a água como base é hidróxido de hidrogênio — os dois nomes existem para a água porque ela pode reagir tanto como ácido quanto como base, dependendo da força do ácido ou da base com que reage (veja anfoterismo). Nenhum desses nomes é usado com freqüência fora desses contextos humorístico.
A água como solvente
Também devido à sua polaridade, a água é um bom solvente. Substâncias que se misturam bem e se dissolvem na água (por exemplo, os sais) são conhecidas como substâncias hidrofílicas, ao passo que as que não se misturam bem em água (por exemplo, gorduras e óleos) são chamadas hidrofóbicas. A capacidade de uma substância se dissolver em água depende de ela poder ou não igualar ou superar as grandes forças atrativas que as moléculas de água exercem umas sobre as outras. Se uma substância tiver propriedades que a impeçam de superar essas grandes forças intermoleculares, suas moléculas são “expulsas” da água, e não se dissolvem. Ao contrário do que normalmente se acredita, a água e as substâncias hidrofóbicas não se “repelem”, e a hidratação de uma superfície hidrofóbica é favorável energeticamente, mas não entropicamente.
Quando um composto iônico ou polar entra em contato com a água, é rodeado por moléculas de água (hidratação). O tamanho relativamente pequeno das moléculas de água tipicamente permite que muitas delas rodeiem uma única molécula de soluto. As extremidades parcialmente negativas do dipolo da água são atraídas pelos componentes positivamente carregados do soluto, e vice-versa com as extremidades positivas.
Em geral, substâncias iônicas e polares como ácidos, álcoois e sais são relativamente solúveis em água, e substâncias apolares como gorduras e óleos, não. Moléculas apolares permanecem juntas na água porque é energeticamente mais favorável para as moléculas de água ligar-se umas às outras por ligações de hidrogênio que se envolverem em interações de van der Waals com as moléculas apolares.
Um exemplo de soluto iônico é o sal de cozinha; o cloreto de sódio, NaCl, se separa em cátions Na+ e ânions Cl−, cada um rodeado por moléculas de água. Os íons são então facilmente separados de sua rede cristalina. Um exemplo de soluto não-iônico é o açúcar comum. Os dipolos da água criam ligações de hidrogênio com as regiões polares da molécula de açúcar (grupos OH) e lhe permitem ser misturada na solução.
A natureza anfótera da água
Quimicamente, a água é anfótera — isto é, pode agir tanto como ácido quanto como base. Ocasionalmente, o termo ácido hidróxico é usado quando a água atua como ácido numa reação química. Em pH7 (meio neutro), a concentração de íons hidróxido (OH−) é igual à dos íons hidrônio (H3O+) ou hidrogênio (H+). Se esse equilíbrio for perturbado, a solução pode se tornar ácida (maior concentração de íons hidrônio) ou básica (maior concentração de íons hidróxido).
De acordo com o sistema de Brønsted-Lowry, um ácido é definido como uma espécie química que perde um próton (um íon H+) numa reação, e uma base, como uma espécie que recebe um próton. Ao reagir com um ácido mais forte, a água atua como base; ao reagir com uma base mais forte, atua como ácido. Por exemplo, ela recebe um íon H+ do ácido clorídrico:

Acima, a água atua como base, recebendo um íon H+.
Na reação com a amônia, NH3, a água perde um íon H+, atuando, pois, como ácido:
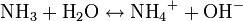
Água Salgada
Após o nosso planeta ser observado e fotografado por várias missões espaciais, foi dito que, ao invés de Terra, o mesmo deveria ser chamado de Água. Quando olhamos a fotografia do planeta, percebemos que a água ocupa a maior parte. O que vemos em branco são nuvens e em marrom os continentes.
Figura 1: TerraA Terra é o único planeta do sistema solar onde existe água na forma líquida. Praticamente todas as formas de vida conhecidas dependem da água, o que explica o fato de ser encontrado organismos apenas na Terra. Suspeitava-se que na Lua havia água, porém pesquisas descartaram esta possibilidade. A água pode ser encontrada também nos satélites de Júpiter.
Figura 2: MarA maior parte da água (cerca de 97% de toda a água) que existe no planeta está nos oceanos e mares. Conhecemos esta água como água salgada, porque contém substâncias chamadas sais.
Figura 3: Rio AmazonasA água também está presente em rios e lagos, porém em menor quantidade que nos oceanos. A água de rios e lagos é conhecida como água doce, porque não possui a enorme quantidade de sal que tem a água do mar. Devemos tomar cuidado com esta definição, porque água doce não quer dizer água com açúcar, mas sim com menos sal em relação à água do mar.
Existe uma grande quantidade de água também debaixo do solo, conhecida como água subterrânea. Dependendo do local, formam-se verdadeiros rios subterrâneos, conhecidos como lençóis d'água ou freáticos. Em muitos locais são feitos poços ou perfurações no solo para se captar esta água. Quando um rio encontra o mar, as águas se misturam, é o que ocorre em áreas de mangue e estuários. Esta água não é doce nem salgada, mas sim água salobra. Os organismos que aí vivem são adaptados às condições deste ambiente. Observamos nesta foto as raízes conhecidas como "escoras", que sustentam as árvores no solo. Os mangues são característicos das áreas tropicais.
Figura 4: MangueA água também está presente no corpo dos seres vivos. Percebemos a existência da água em nosso corpo quando transpiramos, urinamos ou choramos, embora nestes casos a água esteja misturada com outros produtos do nosso metabolismo.
Manuela Graça Santana
A água (H2O, HOH) é a molécula mais abundante na superfície da Terra, e cobre cerca de 70% de sua superfície nas formas líquida e gasosa, além de ser encontrada na atmosfera terrestre como vapor. Está em equilíbrio dinâmico entre os estados líquido e gasoso nas condições ambientes de temperatura e pressão (21-23 °C, 1 atm). À temperatura ambiente, é um líquido fracamente azul, praticamente incolor, insípido e inodoro. Muitas substâncias se dissolvem na água e ela é comumente chamada "solvente universal". Por isso, a água na natureza e em uso raramente é pura, e pode apresentar propriedades diferentes daquelas encontradas no laboratório. Entretanto, há muitos compostos que são essencialmente, se não completamente, insolúveis em água. A água é a única substância comum encontrada em todos os três estados comuns da matéria. A água compõe cerca de 75% do corpo humano.
Formas da água
A água pode assumir várias formas. O estado sólido da água é comumente conhecido como gelo (mas também existem muitas outras formas; veja sólido amorfo e gelo amorfo); o estado gasoso é conhecido como vapor d'água, e a fase líquida comum é geralmente chamada simplesmente de água. Acima de certa temperatura e pressão crítica (647 K e 22,064 MPa), as moléculas de água assumem uma condição supercrítica, em que aglomerados líquidos flutuam numa fase de vapor.
A água pesada é a água cujo hidrogênio é substituído pelo seu isótopo mais pesado, o deutério. A água pesada é quimicamente quase igual à água normal. É usada na indústria nuclear para desaceleração de nêutrons.
Nomenclatura sistemática
A nomenclatura IUPAC aceita para a água é simplesmente "água", mas há dois outros nomes que podem ser usados para descrever a molécula.
O primeiro e mais sistemático é óxido de hidrogênio. Esse nome é análogo ao de compostos correlatos, como o peróxido de hidrogênio (água oxigenada), o sulfeto de hidrogênio e o óxido dedeutério (água pesada). Um outro nome sistemático, oxidano, é aceito pela IUPAC como um nome pai para a nomenclatura sistemática de grupos substituintes baseados em oxigênio,apesar de mesmo estes comumente terem outros nomes recomendados. Por exemplo, o nome hidroxila é recomentado no lugar de oxidanila para o grupo −OH. O nome oxano é explicitamente mencionado pela IUPAC como incompatível com esse propósito, pois já é o nome de um éter cíclico também conhecido como tetra-hidropirano no sistema de Hantzsch-Widman; dentre os compostos semelhantes, existem o dioxano e o trioxano.
Nomenclatura sistemática e humor
Monóxido de diidrogênio (às vezes Monóxido de di-hidrogênio), ou DHMO é um nome sistemático um tanto pedante para a água. O termo foi usado em paródias de pesquisas químicas que clamavam pela abolição dessa "substância química letal". Na verdade, um nome sistemático mais realista seria simplesmente óxido de hidrogênio, já que os prefixos "mono-" e "di-" são supérfluos. O sulfeto de hidrogênio, H2S, nunca é chamado de "monossulfeto de diidrogênio", e o peróxido de hidrogênio, H2O2, nunca é chamado de "dióxido de diidrogênio".
Algumas fichas de dados de segurança de material a respeito da água, exagerando, dizem: "Cuidado! Pode causar afogamento!"
Um outro nome sistemático para a água é ácido hidróxico, ou ácido hidroxílico. De maneira semelhante, o nome para a água como base é hidróxido de hidrogênio — os dois nomes existem para a água porque ela pode reagir tanto como ácido quanto como base, dependendo da força do ácido ou da base com que reage (veja anfoterismo). Nenhum desses nomes é usado com freqüência fora desses contextos humorístico.
A água como solvente
Também devido à sua polaridade, a água é um bom solvente. Substâncias que se misturam bem e se dissolvem na água (por exemplo, os sais) são conhecidas como substâncias hidrofílicas, ao passo que as que não se misturam bem em água (por exemplo, gorduras e óleos) são chamadas hidrofóbicas. A capacidade de uma substância se dissolver em água depende de ela poder ou não igualar ou superar as grandes forças atrativas que as moléculas de água exercem umas sobre as outras. Se uma substância tiver propriedades que a impeçam de superar essas grandes forças intermoleculares, suas moléculas são “expulsas” da água, e não se dissolvem. Ao contrário do que normalmente se acredita, a água e as substâncias hidrofóbicas não se “repelem”, e a hidratação de uma superfície hidrofóbica é favorável energeticamente, mas não entropicamente.
Quando um composto iônico ou polar entra em contato com a água, é rodeado por moléculas de água (hidratação). O tamanho relativamente pequeno das moléculas de água tipicamente permite que muitas delas rodeiem uma única molécula de soluto. As extremidades parcialmente negativas do dipolo da água são atraídas pelos componentes positivamente carregados do soluto, e vice-versa com as extremidades positivas.
Em geral, substâncias iônicas e polares como ácidos, álcoois e sais são relativamente solúveis em água, e substâncias apolares como gorduras e óleos, não. Moléculas apolares permanecem juntas na água porque é energeticamente mais favorável para as moléculas de água ligar-se umas às outras por ligações de hidrogênio que se envolverem em interações de van der Waals com as moléculas apolares.
Um exemplo de soluto iônico é o sal de cozinha; o cloreto de sódio, NaCl, se separa em cátions Na+ e ânions Cl−, cada um rodeado por moléculas de água. Os íons são então facilmente separados de sua rede cristalina. Um exemplo de soluto não-iônico é o açúcar comum. Os dipolos da água criam ligações de hidrogênio com as regiões polares da molécula de açúcar (grupos OH) e lhe permitem ser misturada na solução.
A natureza anfótera da água
Quimicamente, a água é anfótera — isto é, pode agir tanto como ácido quanto como base. Ocasionalmente, o termo ácido hidróxico é usado quando a água atua como ácido numa reação química. Em pH7 (meio neutro), a concentração de íons hidróxido (OH−) é igual à dos íons hidrônio (H3O+) ou hidrogênio (H+). Se esse equilíbrio for perturbado, a solução pode se tornar ácida (maior concentração de íons hidrônio) ou básica (maior concentração de íons hidróxido).
De acordo com o sistema de Brønsted-Lowry, um ácido é definido como uma espécie química que perde um próton (um íon H+) numa reação, e uma base, como uma espécie que recebe um próton. Ao reagir com um ácido mais forte, a água atua como base; ao reagir com uma base mais forte, atua como ácido. Por exemplo, ela recebe um íon H+ do ácido clorídrico:

Acima, a água atua como base, recebendo um íon H+.
Na reação com a amônia, NH3, a água perde um íon H+, atuando, pois, como ácido:
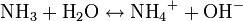
Água Salgada
Após o nosso planeta ser observado e fotografado por várias missões espaciais, foi dito que, ao invés de Terra, o mesmo deveria ser chamado de Água. Quando olhamos a fotografia do planeta, percebemos que a água ocupa a maior parte. O que vemos em branco são nuvens e em marrom os continentes.
Figura 1: TerraA Terra é o único planeta do sistema solar onde existe água na forma líquida. Praticamente todas as formas de vida conhecidas dependem da água, o que explica o fato de ser encontrado organismos apenas na Terra. Suspeitava-se que na Lua havia água, porém pesquisas descartaram esta possibilidade. A água pode ser encontrada também nos satélites de Júpiter.
Figura 2: MarA maior parte da água (cerca de 97% de toda a água) que existe no planeta está nos oceanos e mares. Conhecemos esta água como água salgada, porque contém substâncias chamadas sais.
Figura 3: Rio AmazonasA água também está presente em rios e lagos, porém em menor quantidade que nos oceanos. A água de rios e lagos é conhecida como água doce, porque não possui a enorme quantidade de sal que tem a água do mar. Devemos tomar cuidado com esta definição, porque água doce não quer dizer água com açúcar, mas sim com menos sal em relação à água do mar.
Existe uma grande quantidade de água também debaixo do solo, conhecida como água subterrânea. Dependendo do local, formam-se verdadeiros rios subterrâneos, conhecidos como lençóis d'água ou freáticos. Em muitos locais são feitos poços ou perfurações no solo para se captar esta água. Quando um rio encontra o mar, as águas se misturam, é o que ocorre em áreas de mangue e estuários. Esta água não é doce nem salgada, mas sim água salobra. Os organismos que aí vivem são adaptados às condições deste ambiente. Observamos nesta foto as raízes conhecidas como "escoras", que sustentam as árvores no solo. Os mangues são característicos das áreas tropicais.
Figura 4: MangueA água também está presente no corpo dos seres vivos. Percebemos a existência da água em nosso corpo quando transpiramos, urinamos ou choramos, embora nestes casos a água esteja misturada com outros produtos do nosso metabolismo.
Manuela Graça Santana

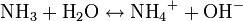
Figura 1: Terra
Figura 2: Mar
Figura 3: Rio Amazonas
Existe uma grande quantidade de água também debaixo do solo, conhecida como água subterrânea. Dependendo do local, formam-se verdadeiros rios subterrâneos, conhecidos como lençóis d'água ou freáticos. Em muitos locais são feitos poços ou perfurações no solo para se captar esta água. Quando um rio encontra o mar, as águas se misturam, é o que ocorre em áreas de mangue e estuários. Esta água não é doce nem salgada, mas sim água salobra. Os organismos que aí vivem são adaptados às condições deste ambiente. Observamos nesta foto as raízes conhecidas como "escoras", que sustentam as árvores no solo. Os mangues são característicos das áreas tropicais.
Figura 4: Mangue
Manuela Graça Santana

Nenhum comentário:
Postar um comentário